CONSEIL
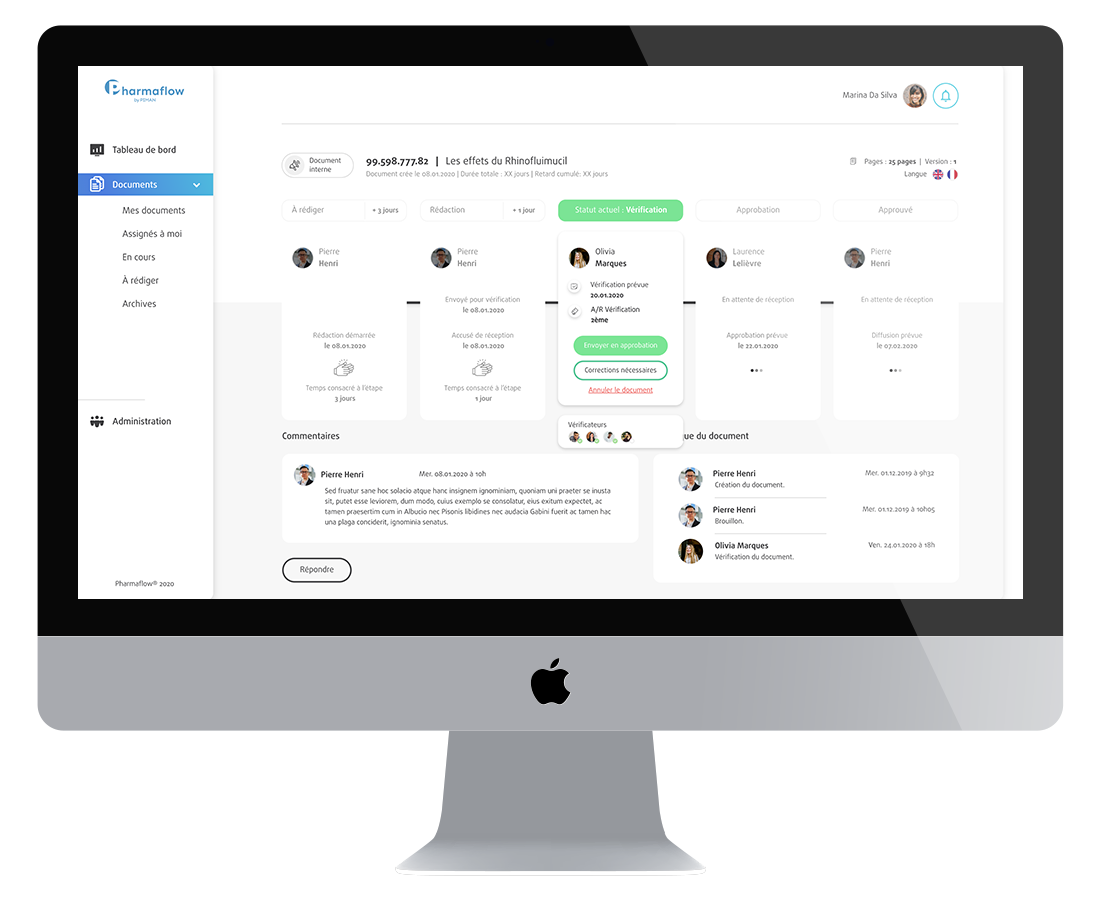
PIMAN Healthcare est l’entité de PIMAN Group spécialisée dans le Conseil et l’expertise dédiée aux industries de la santé (pharmaceutique, dispositifs médicaux...).
Nos consultants experts, ingénieurs formés à la réglementation française et américaine, vous accompagnent et vous guident sur chacun de vos projets : gestion de projet, système de management de la qualité, digitalisation des process, data management, etc.
Nous intervenons dans les domaines pharmaceutiques, de dispositifs médicaux, cosmétiques, d'établissements de santé et de biotechnologies.